I. GIỚI THIỆU
Thuyên tắc huyết khối tĩnh mạch (TTHKTM) (VTE: venous thromboembolism) bao gồm huyết khối tĩnh mạch sâu (HKTMS) (DVT: deep vein thrombosis) và tắc động mạch phổi (TĐMP) (PE: pulmonary embolism). Là nguyên nhân phổ biến đứng hàng thứ ba trong số các bệnh lý tim mạch với tỷ lệ mới mắc hàng năm 100 – 200/100.000 dân [1]. TTHKTM có thể gây tử vong trong trường hợp tổn thương cấp tính, hoặc tiến triển mạn tính và tàn tật, nhưng là bệnh lý có thể phòng ngừa được [2]. TĐMP cấp là biểu hiện lâm sàng trầm trọng nhất của TTHKTM, hầu hết là hậu quả của HKTMS. Đa số các dữ liệu về dịch tễ học, yếu tố nguy cơ, diễn tiến bệnh đều trích từ các nghiên cứu khảo sát HKTMS [3].
Dịch tễ học TĐMP rất khó xác định bởi TĐMP có thể không biểu hiện triệu chứng, hoặc có thể được chẩn đoán rất tình cờ, ở một số trường hợp biểu hiện đầu tiên của TĐMP là tử vong đột ngột [4]. Nghiên cứu của Dalen JE và Alpert JS (1975) ghi nhận tỷ lệ mới mắc hàng năm của TĐMP tại Mỹ là 630.000 người- năm [4]. Ước tính TĐMP là nguyên nhân chủ yếu gây 100.000 trường hợp tử vong và góp phần gây tử vong ở 100.000 trường hợp mắc bệnh trầm trọng khác đồng mắc với TĐMP [5]. Nghiên cứu cho thấy 11% bệnh nhân tử vong trong vòng 1 giờ bị TĐMP, chỉ 29% bệnh nhân được chẩn đoán và điều trị trong số 563.000 bệnh nhân sống sót sau 1h xuất hiện TĐMP [6]. Trong nhóm được chẩn đoán và điều trị sớm (163.000), 92% bệnh nhân sống sót, chỉ 8% tử vong. Trong số 400.000 trường hợp TĐMP không được chẩn đoán, 30% tử vong. Trong số 200.000 trường hợp tử vong chỉ có 6,5% do không đáp ứng với điều trị, 60% do không được chẩn đoán, 33,5% tử vong đột ngột [7].
Nhìn chung, TĐMP là nguyên nhân chủ yếu gây tử vong, mắc bệnh và nhập viện ở châu Âu. Ước tính dựa trên nghiên cứu dịch tễ học năm 2004, khoảng hơn 317.000 trường hợp tử vong liên quan đến TTHKTM ở 6 quốc gia liên hiệp châu Âu (dân số khoảng 454,4 triệu). Trong những trường hợp này, 34% tử vong đột ngột, 59% tử vong là hậu quả của TĐMP không được chẩn đoán trong suốt cuộc đời, chỉ 7% TĐMP được chẩn đoán đúng trước tử vong [1], [8].
Triệu chứng của TĐMP thay đổi rộng, phổ biến nhất bao gồm khó thở đột ngột, theo sau bởi các biểu hiện đau ngực kiểu màng phổi và ho. Tuy nhiên, nhiều bệnh nhân ngay cả các trường hợp TĐMP lớn (massive), các triệu chứng lại nhẹ, thậm chí không triệu chứng [7], [9]. Do vậy, nhằm tăng tính chính xác và hạn chế tỷ lệ tử vong, tiếp cận chẩn đoán TĐMP phải dựa trên hai nguyên tắc: (1) chẩn đoán nhanh và chính xác TĐMP là tối quan trọng vì bệnh nhân có thể tử vong nhanh do TĐMP không được xử trí hoặc nguy cơ chảy máu do dùng thuốc chống đông không cần thiết; (2) chỉ định hợp lý và tích hợp các tham số chẩn đoán khác nhau, bởi rất dễ bỏ sót chẩn đoán nếu sử dụng các tham số chẩn đoán đơn lẻ [6].
Những hướng dẫn chẩn đoán TĐMP hiện nay khuyến cáo tích hợp nhiều yếu tố: hỏi kỹ tiền sử bệnh nhân, đánh giá nguy cơ lâm sàng, xét nghiệm D-dimer, nếu cần thiết sẽ lựa chọn một số kỹ thuật chẩn đoán hình ảnh như chụp CT-PA, xạ hình thông khí - tưới máu, chụp động mạch phổi [1], [3], [8]. Ở những bệnh nhân nghi ngờ TĐMP, các xét nghiệm như khí máu động mạch, các peptide bài natri (BNP, pro-BNP, NT-proBNP), troponin, D-dimer, điện tim, chụp X quang ngực nên được thực hiện [1], [7], [10]. Các xét nghiệm này tuy không nhạy và không đặc hiệu cho chẩn đoán TĐMP nhưng có thể giúp hỗ trợ chẩn đoán xác định cũng như tiên lượng [1]. Xét nghiệm D-dimer có vai trò đặc biệt quan trọng, nếu kết quả D-dimer âm tính kết hợp với khả năng lâm sàng thấp hoặc trung bình có thể giúp loại trừ TĐMP một cách an toàn mà không cần tiến hành thêm bất kỳ một thăm dò hình ảnh nào [11-13].
II. VAI TRÒ CỦA D-dimer TRONG CHẨN ĐOÁN THUYÊN TẮC HUYẾT KHỐI TĨNH MẠCH
-
Nguồn gốc
D-dimer là sản phẩm của quá trình thoái giáng fibrin từ cục máu đông trong lòng mạch. Vì vậy, khi nồng độ D-dimer trong máu bình thường chứng tỏ không có huyết khối trong lòng mạch, khi nồng độ D-dimer trong máu tăng là bằng chứng cho thấy có huyết khối trong lòng mạch [14], [15]. Để hình thành cục máu đông (huyết khối) trong lòng mạch, có thể ở tĩnh mạch hay động mạch, trước hết yếu tố X được hoạt hóa thành Xa (yếu tố X hoạt hóa). Yếu tố Xa cùng với ion Calci và yếu tố V chuyển prothrombin thành trombin. Thrombin chuyển fibrinogen thành fibrinmonomer hòa tan. Fibinmonomer dưới tác động của yếu tố Xa sẽ được trùng hợp để tạo thành fibrinpolymer không hòa tan. Fibrinpolymer tạo thành một mạng lưới giam giữ các thành phần hữu hình của máu để tạo thành cục máu đông. Fibrinmonomer là chuỗi polypeptid gồm các mảnh peptid a, b, c, D, E. Các mảnh a, b, c nhỏ và ngắn còn D và E lớn hơn vì vậy người ta bỏ qua các mảnh a, b, c chỉ chú ý tới các mảnh D và E. Một mảnh E nối với hai mảnh D (D-E-D). Khi trùng hợp, các mảnh D liên kết với nhau để tạo thành một mạng lưới (…D-E-D=D-E-D=D-E-D…). Cục máu đông hình thành, sau một thời gian phải tan đi để cho dòng máu lưu thông được bình thường. Quá trình tan cục máu được kích hoạt do các yếu tố nội sinh chuyển plasminogen thành plasmin. Plasmin thủy phân các dây peptid của lưới fibrinpolymer ở vị trí nối arginin và lysin làm phá vỡ lưới fibrin và tạo ra các chuỗi có hai mảnh D và được gọi là D-dimer và một số sản phẩm có trọng lượng phân tử thấp hòa tan FDPs (fibrin degration products) (Hình 2) [16]. Vì vậy khi có cục máu đông trong lòng mạch sẽ làm tăng nồng độ D-dimer trong máu. Theo một số tác giả, các kháng nguyên D-dimer là dấu ấn duy nhất của quá trình thoái giáng fibrin, được hình thành bởi các tác động tuần tự của 3 enzym: thrombin, yếu tố XIIIa, và plasmin. Đầu tiên, thrombin phân cắt fibrinogen tạo ra các monome fibrin, được trùng hợp và tạo khuôn cho sự hình thành yếu tố XIIIa và plasmin. Thứ hai, thrombin kích hoạt yếu tố XIII huyết thanh tương tác với polymer fibrin để tạo ra các translutaminase hoạt hóa, yếu tố XIII hoạt hóa (XIIIa). Yếu tố XIIIa xúc tác hình thành liên kết hóa trị giữa các vị trí D trong phân tử fibrin trùng hợp. Cuối cùng, plasmin cắt đứt các liên kết ngang của mạng lưới fibrin để tạo ra các sản phẩm thoái giáng fibrin và các kháng nguyên D-dimer [15], [17]. Kháng nguyên D-dimer có thể tồn tại trên các sản phẩm thoái giáng fibrin có nguồn gốc từ fibrin hòa tan trước khi hợp nhất thành fibrin dạng gel, hoặc sau khi cục máu đông bị phân hủy bởi plasmin. Ý nghĩa lâm sàng của xét nghiệm D-dimer đã được đánh giá trong một số trường hợp, đáng chú ý nhất trong việc loại trừ TTHKTM [18], [19].
Bảng 1. Một số nguyên nhân liên quan đến tăng D-dimer [20]
|
Một số nguyên nhân gây tăng D-dimer
|
|
Huyết khối tĩnh mạch
|
|
Nhiễm trùng nặng
|
|
Ung thư
|
|
Đông máu nội mạc rải rác
|
|
Suy tim
|
|
Suy thận
|
|
Nhồi máu cơ tim cấp
|
|
Đột quỵ cấp
|
|
Bệnh mô liên kết
|
|
Bệnh gan
|
|
Bệnh hồng cầu hình liềm
|
|
Có thai
|
|
Hậu phẫu
|
|
Chấn thương
|
|
Chảy máu mới
|
|
Tuổi cao
|
-
Liên quan giữa nồng độ D-dimer và tuổi
Trong số các dấu ấn sinh học khác nhau của huyết khối, D-dimer hiện được coi là tiêu chuẩn vàng sinh hóa để hỗ trợ chẩn đoán VTE (DVT và PE). D-dimer là sản phẩm phân hủy của fibrin ổn định, được hình thành bởi sự tương tác sinh lý giữa đông máu và tiêu sợi huyết. Sự gia tăng nồng độ của dấu ấn sinh học này trong máu do đó phản ánh sự kích hoạt tuần tự của thrombin, yếu tố XIII và plasminogen. Mặc dù khái niệm này hầu như không còn vấn đề gì phải bàn cãi, nhưng việc phiên giải xét nghiệm D-dimer ở người cao tuổi vẫn còn nhiều thách thức.
Đầu tiên, những thay đổi liên quan đến tuổi được đề cập trước đây trong vi tuần hoàn và đông máu góp phần tạo ra trạng thái tăng đông được phản ảnh qua quan sát sự tăng dần của các dấu ấn sinh học tiền đông, bao gồm cả D-dimer. Sau đó, những bệnh nhân cao tuổi bị nghi ngờ VTE thường có một số bệnh đi kèm, đặc biệt là nhiễm trùng, suy tim và ung thư, tất cả đều góp phần trực tiếp làm tăng nồng độ D-dimer, và cuối cùng làm giảm độ đặc hiệu chẩn đoán của xét nghiệm này đối với VTE hoặc các rối loạn huyết khối điển hình khác như đông máu nội mạch rải rác (disseminated intravascular coagulation). Những bằng chứng này đã mở đường cho các nghiên cứu khoa học nhằm xác định các giá trị chuẩn, tùy thuộc theo tuổi của D-dimer có thể giúp loại trừ VTE một cách an toàn ở những bệnh nhân cao tuổi mà không cần phải chỉ định thêm các thăm dò chẩn đoán khác.
Cách tiếp cận đúng đắn nhất và được sử dụng rộng rãi nhất đòi hỏi một công thức cụ thể, trong đó ngưỡng chẩn đoán ở những bệnh nhân từ 50 tuổi trở lên được tính toán lại như sau: (điểm cắt được hiệu chỉnh, đơn vị tương đương fibrinogen [FEU] [tuổi, tính theo năm] x 10). Trong một tổng quan hệ thống và phân tích gộp các tài liệu khoa học gần đây, Schouten và cộng sự đã kết luận các giá trị ngưỡng được hiệu chỉnh theo tuổi có độ nhạy chẩn đoán giống hệt nhau (ví dụ 0,97) so với ngưỡng D-dimer quy ước nhưng thể hiện độ đặc hiệu cao hơn qua các nhóm tuổi khác nhau (ví dụ: 0,62 so với 0,58 ở bệnh nhân 51-60 tuổi, 0,50 so với 0,39 ở nhóm 61-70 tuổi, 0,44 so với 0,25 ở nhóm 71-80 và 0,35 so với 0,15 ở những người trên 80 tuổi). Phát hiện này được xác thực trong nhiều nghiên cứu sau đó.
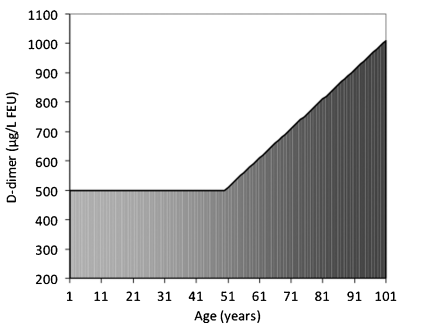
Hình 1. Liên quan giữa nồng độ D-dimer và tuổi
-
Vai trò của một số kỹ thuật xét nghiệm D-dimer trong TTHKTM
Các xét nghiệm D-dimer được ứng dụng từ những năm 1980 trong loại trừ TTHKTM [12], [21]. Mặc dù được đề cập nhiều, vai trò của D-dimer trong chẩn đoán HKTMS hoặc TĐMP không rõ ràng, một phần do có nhiều phương pháp xét nghiệm D-dimer, vai trò của các trung tâm xét nghiệm so với các xét nghiệm nhanh tại giường, mối quan tâm về sự biến thiên của các kỹ thuật xét nghiệm [11], [22]. Một tổng hợp hệ thống các tài liệu cho thấy trong số các kỹ thuật xét nghiệm D-dimer, xếp theo các giá trị độ nhạy và tỷ số khả dĩ để loại trừ chắc chắn TĐMP, các giá trị độ nhạy của phương pháp ELISA (miễn dịch gắn enzyme) và ELISA nhanh định lượng có giá trị vượt trội đáng kể so với kỹ thuật latex bán định lượng và xét nghiệm ngưng kết máu toàn phần [23], [24]. Ở những bệnh nhân có khả năng lâm sàng TĐMP thấp, kết quả xét nghiệm D-dimer âm tính cho phép loại trừ TĐMP một cách an toàn [25], [26]. Ở những bệnh nhân TĐMP, độ nhạy cao nhất của xét nghiệm ELISA khi sử dụng ngưỡng điểm cắt 500 ng/ml [27]. Sự thay đổi giá trị độ nhạy thường ít hơn đối với các xét nghiệm ELISA. Xét nghiệm ELISA và ELISA nhanh định lượng có tỷ số khả dĩ âm là 0,05 - 013. Tỷ số khả dĩ < 0,1 tạo ra những thay đổi lớn và thường kết luận từ các khả năng trước test đến sau test, cung cấp bằng chứng chắc chắn để loại trừ TĐMP [14], [28]. Kết hợp giữa kết quả ELISA nhanh âm tính với xác suất lâm sàng thấp hoặc trung bình đủ cơ sở để loại trừ TĐMP. Tuy nhiên, một kết quả D-dimer âm tính không đủ tin cậy để loại trừ TĐMP nếu khả năng lâm sàng cao [29], [30]. Hơn nữa, kết quả D-dimer âm có trị số dự báo âm cao nhất chỉ trong quần thể có tỷ lệ TĐMP thấp. Ước tính trị số dự báo âm của xét nghiệm ELISA nhanh định lượng trong loại trừ TĐMP có độ nhạy 97% và độ đặc hiệu 41% [12], [20]. Tỷ lệ TĐMP trong các nghiên cứu về vai trò của D-dimer dao động 8-62% (trung bình 25%). Nếu tỷ lệ TĐMP trong dân số được xét nghiệm là 25%, trị số dự báo âm của xét nghiệm ELISA nhanh định lượng 98%. Nếu tỷ lệ hiện mắc TĐMP là 8%, trị số dự báo âm sẽ là 99%. Nếu tỷ lệ hiện mắc TĐMP là 62%, trị số dự báo âm có thể chỉ 89% [16], [31].
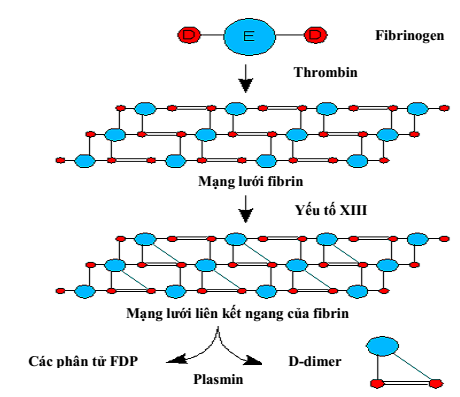
Hình 2. Sự hình thành D-dimer [16]
Dữ liệu nghiên cứu chỉ ra độ nhạy, độ đặc hiệu và tỷ số khả dĩ hiện có đưa ra các giá trị điểm cắt của dao động từ 250 - 1000 ng/ml đối với một số phương pháp xét nghiệm D-dimer nhưng không phải tất cả các kỹ thuật [32], [33]. Giá trị lâm sàng là giới hạn bởi kết quả dương tính không đặc hiệu do nhiều yếu tố như viêm, chấn thương, và phẫu thuật. Bên cạnh đó, giá trị lâm sàng cũng khác nhau giữa các quần thể bệnh nhân [31], [34]. Bệnh nhân nội trú có thể loại trừ TĐMP bởi kết quả D-dimer âm tính có tỷ lệ thấp hơn bệnh nhân ngoại trú, vì bệnh nhân nội trú thường xuyên hơn có các rối loạn không liên quan đến TĐMP, có thể gây ra một kết quả xét nghiệm D-dimer dương tính [11], [17]. Tương tự, ở những bệnh nhân có tiền sử TĐMP hoặc HKTMS tỷ lệ kết quả D-dimer bình thường thấp hơn ở những bệnh nhân không có tiền sử TĐMP hoặc HKTMS từ trước.
-
Vai trò của D-dimer trong loại trừ TTHKTM
Việc chẩn đoán TTHKTM dựa trên các kỹ thuật chẩn đoán hình ảnh gây tăng chi phí và mất nhiều thời gian, chưa kể một số bệnh nhân có các chống chỉ định với các kỹ thuật hình ảnh [12], [25]. Khi bệnh nhân đến khoa cấp cứu trong tình trạng một chân sưng to hoặc đau ngực, các bác sĩ đang phải đối mặt với một chẩn đoán phân biệt rất rộng, đặc biệt ở những bệnh nhân đau ngực [18], [28]. Khi có đông máu nội mạch, thậm chí rất hạn chế nhưng dẫn đến ly giải fibrin và cuối cùng gây tăng D-dimer trong máu, trường hợp này cũng đúng đối với TTHKTM [35], [36]. Trên thực tế một số bệnh nhân có TĐMP mức độ trung bình có thể có nồng độ D-dimer rất cao. Ban đầu, các xét nghiệm D-dimer được sử dụng như một công cụ để chẩn đoán TTHKTM và tìm ra một giá trị D-dimer đủ cao để hỗ trợ chẩn đoán TTHKTM [17], [37], [38]. Vào cuối những năm 1980 và đầu những năm 1990, nhóm các nhà nghiên cứu đã bắt đầu báo cáo về việc sử dụng xét nghiệm D-dimer để loại trừ TTHKTM ở những bệnh nhân có sưng chân một bên hoặc có triệu chứng đau ngực. Điều này giúp đánh giá tình trạng lâm sàng một cách nhanh chóng và giảm chi phí cho bệnh nhân [33], [39], [40]. Tuy nhiên việc này sẽ dẫn đến một số rủi ro, chẳng hạn nếu kết quả D-dimer âm tính nhưng là âm tính giả sẽ dẫn đến bỏ sót chẩn đoán và hậu quả là bệnh nhân không được điều trị kịp thời, gây tăng các biến cố mắc bệnh và tử vong cao [19], [21], [41]. Do vậy, nhiều nghiên cứu sau đó đã đưa ra các tiêu chí khi sử dụng kết quả D-dimer để loại trừ TTHKTM và độ tin cậy giá trị NPV của xét nghiệm nghiệm [20], [36], [37]. Đó là lý do dẫn đến sự xuất hiện các hướng dẫn sử dụng D-dimer trong loại trừ TTHKTM [1], [12], [42].
-
Khả năng lâm sàng và lựa chọn bệnh nhân
Giá trị độ nhạy, độ đặc hiệu, giá trị dự báo của bất kỳ phương pháp xét nghiệm D-dimer nào cũng bị ảnh hưởng đáng kể bởi một số tình trạng bệnh lý trong dân số nghiên cứu [14]. Như vậy, đối với việc sử dụng các xét nghiệm D-dimer để loại trừ chính xác bệnh nhân không có TTHKTM, điều quan trọng những bệnh nhân này phải có khả năng lâm sàng TĐMP thấp [20], [43]. Chính vì vậy, dẫn đến sự phát triển của các tiêu chí lâm sàng đánh giá huyết khối trước test và có thể được áp dụng trước khi làm xét nghiệm D-dimer [36], [43]. Hai thang điểm được ứng dụng phổ biến nhất trên lâm sàng gồm thang điểm Wells (gồm hai bảng điểm riêng biệt cho TĐMP và HKTMS) và thang điểm Geneva (áp dụng cho TĐMP) [13], [29], [39]. Ở mỗi bảng điểm, sau khi cho điểm ở từng tiêu chí, có hai hình thái phân loại tình trạng lâm sàng: (1) đối với thang điểm 3 mức: khả năng lâm sàng thấp, trung bình, cao; hoặc (2) đối với thang điểm hai mức: phù hợp và không phù hợp TĐMP. Trong trường hợp nghi ngờ HKTMS: (1) khả năng lâm sàng thấp: tỷ lệ HKTMS là 4-8%, (2) khả năng lâm sàng trung bình: tỷ lệ HKTMS là 13-23%, (3) khả năng lâm sàng cao, tỷ lệ HKTMS là 44-61% [19], [43], [44]. Trong các trường hợp khả năng lâm sàng thấp phối hợp với kết quả xét nghiệm D-dimer định lượng âm tính có thể loại trừ TĐMP hoặc HKTMS mà không cần chỉ định thêm các kỹ thuật chẩn đoán hình ảnh. Trong trường hợp khả năng lâm sàng thấp hoặc trung bình kết hợp với kết quả xét nghiệm D-dimer định lượng âm tính có thể loại trừ TĐMP hoặc HKTMS nếu giá trị của xét nghiệm đạt được các tiêu chí nghiêm ngặt về độ nhạy, độ đặc hiệu và trị số dự báo âm theo các hướng dẫn dựa trên bằng chứng [21], [26], [41].
Bảng 2. Thang điểm Wells [1], [32]
|
Đặc điểm lâm sàng
|
Điểm dự báo
|
|
Tiền sử TĐMP hoặc HKTMS từ trước
|
1.5
|
|
Nhịp tim > 100 lần/phút
|
1.5
|
|
Phẫu thuật hoặc bất động trong 4 tuần vừa qua
|
1.5
|
|
Ho máu
|
1
|
|
Ung thư tiến triển
|
1
|
|
Dấu hiệu lâm sàng của HKTMS
|
3
|
|
Chẩn đoán khác ít khả năng so với TĐMP
|
3
|
|
Khả năng lâm sàng
|
|
|
Thang điểm 3 mức
|
|
Thấp
|
0 - 1
|
|
Trung bình
|
2- 6
|
|
Cao
|
> 6
|
|
Thang điểm 2 mức
|
|
|
Ít khả năng TĐMP
|
0 – 4
|
|
Khả năng TĐMP
|
≥ 5
|
|
D-dimer giúp loại trừ TĐMP khi phối hợp với thang điểm Wells < 5
|
Bảng 3. Đánh giá nguy cơ HKTMS theo thang điểm Wells PS [31]
|
Tiêu chuẩn lâm sàng
|
Điểm
|
|
Bệnh lý ác tính tiến triển (trong vòng 6 tháng, đang điều trị hoặc chăm sóc giảm nhẹ)
|
1
|
|
Liệt hay mới bó bột
|
1
|
|
Nằm liệt giường > 3 ngày; phẫu thuật lớn ≤4 tuần
|
1
|
|
Đau dọc tĩnh mạch sâu
|
1
|
|
Sưng toàn bộ chân
|
1
|
|
Sưng bắp chân 1 bên > 3 cm
|
1
|
|
Có tuần hoàn bàng hệ của các tĩnh mạch nông (không phải là chứng giãn tĩnh mạch)
|
1
|
|
Phù lõm
|
1
|
|
Tiền sử được chẩn đoán huyết khối tĩnh mạch sâu
|
1
|
|
Có chẩn đoán khác thay thế, ít nguy cơ bị HKTMS
|
- 2
|
|
Nhiều khả năng HKTMS: ≥ 2 điểm; Ít khả năng HKTMS < 2 điểm. Ở những bệnh nhân có triệu chứng cả 2 chân, chân nhiều chiệu chứng hơn được sử dụng.
|
Bảng 4. Thang điểm Geneva cải tiến [1]
|
Đặc điểm lâm sàng
|
Điểm dự báo
|
|
Tiền sử TĐMP hoặc HKTMS từ trước
|
3
|
|
Nhịp tim
|
|
|
75 – 94 lần/phút
|
3
|
|
≥ 95 lần/phút
|
5
|
|
Phẫu thuật hoặc gãy xương trong 1 tháng qua
|
2
|
|
Ho máu
|
2
|
|
Ung thư tiến triển
|
2
|
|
Đau chi dưới một bên
|
3
|
|
Đau khi ấn tĩnh mạch sâu chi dưới và phù một bên
|
4
|
|
Tuổi > 65
|
1
|
|
Khả năng lâm sàng
|
|
|
Thang điểm 3 mức
|
|
|
Thấp
|
0-3
|
|
Trung bình
|
4-10
|
|
Cao
|
> 11
|
|
Thang điểm 2 mức
|
|
|
Ít khả năng TĐMP
|
0-5
|
|
Nhiều khả năng TĐMP
|
≥ 6
|
|
D-dimer giúp loại trừ TĐMP khi thang điểm Geneva < 6
|
Xét nghiệm D-dimer không được chỉ định cho mục đích loại trừ TTHKTM ở những bệnh nhân có khả năng lâm sàng cao [12], [42]. Tất cả bệnh nhân có khả năng lâm sàng cao cần phải chỉ định thêm các thăm dò chẩn đoán hình ảnh để khẳng định hoặc loại trừ chẩn đoán [31]. Có hai lý do chính để tránh làm xét nghiệm D-dimer trong loại trừ TTHKTM ở những bệnh nhân có khả năng lâm sàng cao: (1) xác suất xuất hiện huyết khối là đủ cao dựa trên kết quả thăm dò hình ảnh ở bất cứ nồng độ D-dimer nào. (2) kết quả xét nghiệm âm tính có tỷ lệ âm tính giả cao dẫn đến bỏ sót chẩn đoán [37], [38]. Bởi vì dựa trên kết quả đánh giá khả năng lâm sàng sẽ quyết định việc có chỉ định xét nghiệm D-dimer hay là không. Nhiều tác giả chỉ sử dụng đánh giá khả năng lâm sàng bằng thang điểm hai mức [40], [45]. Cần phải nhấn mạnh rằng D-dimer không nên được sử dụng để loại trừ TTHKTM ở những bệnh nhân có khả năng lâm sàng cao. Giá trị cao nhất của xét nghiệm D-dimer được ghi nhận trong các trường hợp tách động mạch chủ và TĐMP cấp [24], [41]. Một giá trị D-dimer tăng cao > 2000 μg FEU/L sẽ hữa ích trong chẩn đoán phân biệt các nguyên nhân đau ngực [41], [46].
-
Độ nhạy, độ đặc hiệu và trị số dự báo của D-dimer ở bệnh nhân TTHKTM
Nhìn chung, xét nghiệm D-dimer định lượng có thể được sử dụng ở những bệnh nhân có khả năng lâm sàng thấp hoặc trung bình [41]. Tuy nhiên các xét nghiệm cần phải đáp ứng các tiêu chí quy định bởi trị số dự báo lý thuyết. Mối quan tâm lớn nhất là trị số dự báo âm và độ nhạy của xét nghiệm [34], [43]. Để đưa ra một ngưỡng giá trị D-dimer, độ nhạy phải rất cao và độ đặc hiệu tướng ứng cùng mức [17], [30]. Khuyến cáo của ủy ban đông máu và huyết khối của Anh đưa ra NPV là 98% [14].
Bảng 5. Liên quan giữa khả năng lâm sàng trước test và tỷ lệ TĐMP [21]
|
Khả năng lâm sàng trước test
|
Tỷ lệ TĐMP (%)
|
|
Thấp
|
1-3
|
|
Trung bình
|
13-21
|
|
Cao
|
29-54
|
Bảng 6. Độ nhạy, độ đặc hiệu của các phương pháp xét nghiệm D-dimer [31]
|
|
Ngưng kết latex
|
|
|
ELFA
|
ELISA
|
Đo độ đục Miễn dịch
|
Bán định lượng
|
Định lượng
|
Máu toàn phần
|
|
Huyết khối tĩnh mạch sâu
|
|
Se
(95% CI)
|
96%
(89-98)
|
94%
(86-97)
|
93%
(89-95)
|
85%
(68-93)
|
69%
(27-93)
|
83%
(67-93)
|
|
Sp
(95% CI)
|
46%
(31-61)
|
53%
(38-68)
|
53%
(46-61)
|
68%
(53-81)
|
99%
(94-100)
|
71%
(57-92)
|
|
Tắc động mạch phổi
|
|
Se
(95% CI)
|
97%
(88-99)
|
95%
(84-99)
|
95%
(88-98)
|
88%
(66-97)
|
75%
(25-96)
|
87%
(64-96)
|
|
Sp
(95% CI)
|
43%
(23-65)
|
50%
(29-71)
|
50%
(36-64)
|
66%
(43-83)
|
99%
(94-100)
|
69%
(48-84)
|
Tóm lại, việc khẳng định loại trừ TTHKTM đòi hỏi phải theo dõi lâm sàng tất cả các bệnh nhân không có TTHKTM lúc chẩn đoán và phải sử dụng tham điểm lâm sàng trước test để loại những trường hợp các bệnh nhân có khả năng lâm sàng cao [31]. Đối với trường hợp hỗ trợ chẩn đoán, các xét nghiệm phải được thể hiện là "tương đương đáng kể " so với một kỹ thuật xét nghiệm tham chiếu đã được phê duyệt. Để đạt được độ tin cậy cần thiết về độ nhạy và trị số dự báo âm, cần phải có một số lượng quần thể nghiên cứu đủ lớn [23], [41]. Theo tiêu chuẩn của Ủy ban Anh cần tối thiểu là 200 đối tượng. Tiêu chuẩn FDA cần hơn 250-350 đối tượng đối với những nghiên cứu TĐMP và HKTMS riêng biệt và thu thập dữ liệu từ ít nhất ba nguồn khác nhau. Để đạt được số lượng bệnh nhân như vậy là vượt ra ngoài khả năng của gần như tất cả viện nghiên cứu, dẫn đến các khuyến cáo rằng các ngưỡng để loại trừ TTHKTM sử dụng trên lâm sàng được công bố theo phương pháp của nhà sản xuất đính kèm trong bao bì [15], [16]. Ngoài ra nếu thay đổi các phương pháp phòng xét nghiệm và độ lớn của các đơn vị, các sai sót sẽ tăng. Các phòng xét nghiệm tính toán thay đổi các đơn vị (loại và/hoặc độ lớn) cũng làm tăng tỷ lệ lỗi trong các quy tình kỹ thuật. Do đó khuyến cáo các phòng xét nghiệm cung cấp các chất phản ứng tương tự và dụng cụ được sử dụng, các phòng thí nghiệm chỉ sử dụng loại và độ lớn của các đơn vị được công bố trên bao bì [11], [30]. Một số khuyến cáo các phòng xét nghiệm địa phương xác minh mức độ ngưỡng của nhà sản xuất; Tuy nhiên, vấn đề là cùng một số bệnh nhân, cần phải làm như một nghiên cứu thực tế cho hầu hết các phòng xét nghiệm. Bởi nồng độ D-dimer tăng cao trong nhiều tình trạng bệnh lý khác nhau ở bệnh nhân nhâp viện (80% bệnh nhân nhập viện có D-dimer tăng), vì vậy sử dụng D-dimer để loại trừ của TTHKTM ở bệnh nhân nội trú không được khuyến cáo [17], [34]. Một số bình luận về vai trò có lợi của xét nghiệm D-dimer tại các trung tâm cấp cứu [28]. Hiện tại đang có một nỗ lực để giảm bớt việc sử dụng các kết quả của các phòng xét nghiệm. Khoảng hơn 84% các trường hợp trong đó xét nghiệm D-dimer có giá trị lâm sàng nhưng không được chỉ định bởi sự cần thiết phải đánh giá khả năng lâm sàng trước test cũng như sự phức tạp của các đánh giá lâm sàng [11], [18].
-
Đánh giá nguy cơ huyết khối tái phát sau điều trị
Sau các biến cố huyết khối, bệnh nhân có nguy cơ cao tái phát huyết khối sau khi ngừng thuốc chống đông [29]. Nguy cơ này thấp hơn nếu TTHKTM xác định được yếu tố khởi phát (ví dụ: du lịch bằng máy bay kéo dài, mang thai, hoặc liệu pháp estrogen) so với TTHKTM không có yếu tố khởi phát với tỉ lệ tái phát 1% và 5% theo thứ tự tại thời điểm 1 năm; 3% và 15% sau 5 năm theo thứ tự, tỷ lệ tái phát còn cao hơn trong nhóm bệnh ác tính [35], [47]. Cách phòng ngừa duy nhất hiện nay là tiếp tục dùng thuốc chống. Việc dùng thuốc chống đông kéo dài cũng xuất hiện nhiều rủi ro, chính vì vậy cần xác định được lợi ích và nguy cơ rõ ràng trên từng bệnh nhân cụ thể [19], [38]. Một số nghiên cứu ghi nhận những bệnh nhân có D-dimer tăng (bằng chứng về hoạt động đông máu) có nguy cơ tái phát huyết khối lớn hơn đáng kể so với những bệnh nhân có nồng độ D-dimer thấp khi dừng thuốc chống đông [16], [31]. Một nghiên cứu trên 708 bệnh nhân sử dụng thuốc chống đông ít nhất 3 tháng, xét nghiệm D-dimer được thực hiện tại thời điểm 1 tháng sau khi ngừng thuốc chống đông, những bệnh nhân này vẫn có D-dimer trong khoảng giá trị tham chiếu. Những người có xét nghiệm D-dimer dương tính được phân nhóm ngẫu nhiên thành hai nhóm ngừng hoặc vẫn tiếp tục điều trị chống đông, quá trình đánh giá, theo dõi các biến cố huyết khối được làm mù. Những bệnh nhân có kết quả D-dimer âm tính và dương tính sau khi vẫn tiếp tục được điều trị chống đông có kết quả tốt hơn nhóm dương tính không được điều trị [19], [47], [48]. Hiện vẫn không có các hướng dẫn về số lượng (điều trị và dự phòng) cũng như khoảng thời gian sử dụng thuốc chống đông cho những bệnh nhân có D-dimer tăng sau khi kết thúc liệu pháp chống đông điều trị TTHKTM [5]. Việc kết hợp nhiều dữ liệu (lâm sàng, cận lâm sàng) sẽ giúp dự báo khả năng tái phát huyết khối chính xác hơn [6], [8]. Trong nghiên cứu PROLONG, trong số những bệnh nhân có kết quả D-dimer âm tính, tỷ lệ tái phát huyết khối ở nam cao hơn nữ [16], [49]. Trong một phân tích meta khác, tổng số 1.818 bệnh nhân được thu thập từ 7 nghiên cứu, theo dõi trong 5 năm, các yếu tố ban đầu giúp dự báo khả năng tái phát là D-dime tăng, tuổi < 50, nam giới, thiếu mối liên quan đến liệu pháp hormon [24], [41].
-
D-dimer và thai kỳ
Có nguy cơ xuất hiện TTHKTM trong khi mang thai, đặc biệt trong thời gian diễn ra cuộc đẻ. Tỷ lệ huyết khối khoảng 1/1000 phụ nữ mang thai. Trong thời kỳ mang thai, nồng độ D-dimer tăng liên tục, trung bình 286 ng DDU/ml vào quý 1, khoảng 457 ng DDU/ml vào quý 2 và 644 ng DDU/l vào quý 3. Do đó giảm rõ rệt vai trò loại trừ TTHKTM của D-dimer. Một số nghiên cứu đã tăng ngưỡng D-dimer để loại trừ TTHKTM nhưng số liệu nghiên cứu còn hạn chế [15], [37], [43].
-
D-dimer và người cao tuổi
Nồng độ D-dimer cũng tăng theo tuổi, ở những bệnh nhân > 80 tuổi, sử dụng D-dimer để loại trừ TTHKTM không được khuyến cáo do tỷ lệ dương tính giả cao đến mức khó chấp nhận. Một nghiên cứu đã đề xuất các ngưỡng khác nhau để loại trừ TTHKTM ở các trường hợp <70 tuổi và > 70 tuổi, tuy nhiên kết hợp giữa ngưỡng D-dimer và khả năng lâm sàng thấp là quan trọng để loại trừ an toàn TTHKTM [11], [15], [43].
-
D-dimer và bệnh ác tính
Độ nhạy xét nghiệm phát hiện D-dimer dựa trên mức độ cơ bản của những người khỏe mạnh, lên đến 250 ng DDU / mL [40], [43]. Ở mức độ thường gặp này chỉ ra hiện tượng đông máu đang xảy ra ở mức độ thấp, có khả năng giống như mối liên quan với các đợt chấn thương dưới lâm sàng và sửa chữa ở nhiều vị trí của cơ thể, các biến cố này tăng khi có thai, có thể tại vị trí tiếp xúc giữa bánh rau và niêm mạc tử cung [31], [44]. Tương tự, nồng độ D-dimer cũng tăng trong trường hợp mắc các bệnh ác tính, giá trị D-dimer tăng thay đổi theo loại bệnh ác tính cũng như giai đoạn bệnh. Nguy cơ TTHKTM tăng trong bệnh ác tính cũng được ghi nhận, với một số khuyến cáo cho rằng TTHKTM không có yếu tố khởi phát ở người cao tuổi có thể có các bệnh ác tính. Sử dụng D-dimer trong loại trừ TTHKTM ở bệnh nhân mắc bệnh ác tính là vấn đề đặc biệt khó [50]. Hơn nữa, nồng độ D-dimer tăng ở những bệnh nhân không có TTHKTM trên lâm sàng liên quan đến tiên lượng kém [31], [34].
-
Loại trừ TTHKTM ở bệnh nhân mắc bệnh ác tính
Sử dụng kết quả D-dimer để loại trừ TTHKTM ở bệnh nhân có bệnh ác tính bị hạn chế bởi nồng độ D-dimer luôn thay đổi. Ngoài ra còn bị ảnh hưởng bởi nhiều tình trạng lâm sàng đi kèm như hóa trị, đường truyền tĩnh mạch trung tâm, phẫu thuật, và nhập viện vì nhiều lý do khác [21], [50]. Ở những bệnh nhân có bệnh ác tính và khả năng lâm sàng TTHKTM thấp hoặc trung bình, kết quả D-dimer âm tính có thể loại trừ an toàn TTHKTM [26]; Tuy nhiên, nồng độ D-dimer tăng cao trong các bệnh ác tính khá thay đổi, sự kết hợp là bất thường ở bệnh nhân nghi ngờ TTHKTM (chỉ 15% trường hợp) [18], [51]. Tỷ lệ này là cao vì thực tế nguyên nhân ác tính đã được tích hợp trong các hệ thống thang điểm Wells và Geneva [1], [9].
-
Chẩn đoán, phân tầng nguy cơ TTHKTM trong nhóm bệnh ác tính
Trong nghiên cứu tiến cứu 2.263 bệnh nhân nghi ngờ HKTMS, một số yếu tố liên quan đến tiên lượng kém gồm tuổi > 60, nồng độ D-dimer > 4000 ng FEU/mL [32], [38], [52]. Trong số 247 bệnh nhân (10,9%) có bệnh ác tính đã biết hoặc được chẩn đoán bệnh ác tính trong thời gian 22 tháng theo dõi, mức độ tăng D-dimer không phải do sự xuất hiện của huyết khối mà do bản chất sinh học của khối u [41]. Ngoài ra, tỷ lệ mới mắc các bệnh ác tính cũng tăng ở những bệnh nhân HKTMS và có nồng độ D-dimer trên 8000 ng FEU/mL. Mặc dù có sự gia tăng nguy cơ thuyên tắc huyết khối ở bệnh nhân có các bệnh ác tính, việc xác định các yếu tố nguy cơ để quyết định sử dụng chống đông dự phòng vẫn chưa rõ ràng [17], [37]. Trong một nghiên cứu 821 bệnh nhân ung thư đang tiến triển chỉ ra có sự gia tăng nguy cơ TTHKTM. Nguy cơ cộng dồn 6 tháng là 15,2% khi phối hợp với tăng nồng độ D-dimer và 5% khi tăng D-dimer đơn thuần [21], [30]. Kết hợp D-dimer tăng với các xét nghiệm khác và các đánh giá lâm sàng có thể xác định được nguy cơ huyết khối trong dân số ung thư là 35%. Sử dụng phương thức này để phân tầng bệnh nhân từ đó quyết định dự phòng chống đông vẫn cần chờ thêm bằng chứng rõ ràng hơn [20], [42].
-
Phối hợp D-dimer với khả năng lâm sàng để loại trừ TĐMP cấp
Phối hợp kết quả xét nghiệm ELISA nhanh âm tính (enzyme-linked immunosorbent assay) với khả năng lâm sàng thấp hoặc trung bình về cơ bản loại trừ được TĐMP [25]. Tương tự như vậy, các xét nghiệm D-dimer không phải bằng kỹ thuật ELISA nếu kết hợp với khả năng lâm sàng thấp (không phải khả năng lâm sàng trung bình) cũng giúp loại trừ TĐMP [12]. Nếu khả năng lâm sàng TĐMP trước test cao, ví dụ 70% hoặc cao hơn, xác suất của TĐMP lớn hơn 20% [18], [51], thậm chí với kết quả D-dimer âm tính, không phân biệt xét nghiệm D-dimer bằng kỹ thuật ngưng kết máu toàn phần hoặc kỹ thuật ELISA định lượng . Rõ ràng, nếu kết quả đánh giá lâm sàng có khả năng TĐMP cao, không phân biệt kết quả D-dimer âm tính, đều cho thấy cần thiết phải có các thăm dò thêm để chẩn đoán xác định hay loại trừ TĐMP [20], [30], [43]. Kết quả xét nghiệm D-dimer âm tính bằng kỹ thuật ELISA nhanh định lượng hoặc bằng kỹ thuật ngưng kết máu toàn phần chỉ có ý nghĩa trong trường hợp khả năng lâm sàng TĐMP thấp hoặc trung bình [18], [36]. Mở rộng mô hình cho thấy khi khả năng lâm sàng thấp, khả năng sau test đối với xét nghiệm D-dimer bằng kỹ thuật ngưng kết máu toàn phần là 6%, nhưng đối với kỹ thuật ELISA nhanh là 2%. Với khả năng lâm sàng trung bình, khả năng sau test đối với xét nghiệm D-dimer bằng kỹ thuật ngưng kết máu toàn phần là 16%, nhưng đối với kỹ thuật ELISA nhanh là 7% [16], [52].
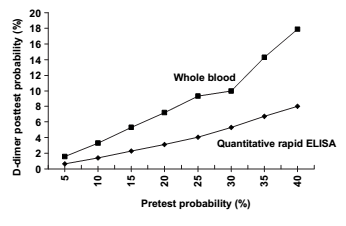




Hình 3. Liên quan giữa các phương pháp xét nghiệm
khả năng trước và sau test [21]
Phương pháp ELISA nhanh định lượng nếu âm tính cho phép loại trừ TĐMP một cách an toàn nếu khả năng lâm sàng thấp hoặc trung bình [26]. Nhưng đối với kỹ thuật ngưng kết máu toàn phần, việc loại trừ TĐMP có thể không chắc chắn [21], [47]. Xét nghiệm D-dimer máu toàn phần phối hợp đánh giá lâm sàng ở một số lượng nhỏ bệnh nhân cho thấy TĐMP gặp 2,7% ở những bệnh nhân có thang điểm Wells < 2 (khả năng lâm sàng thấp) và 0,3 - 1,7% đối với thang điểm Wells < 4 (không phù hợp TĐMP). Với xét nghiệm D-dimer bằng kỹ thuật ELISA nhanh kết hợp với khả năng lâm sàng không phù hợp (unlikely) TĐMP theo thang điểm Wells, trong thời gian theo dõi 3 tháng, TĐMP gặp 0,4% và HKTMS gặp 0,1% [13], [18], [31], [47]. Nếu xét nghiệm D-dimer bằng phương pháp ELISA nhanh kết hợp với khả năng lâm sàng thấp hoặc trung bình theo bảng điểm Geneva gốc, kết quả không phát hiện trường hợp nào TĐMP trong thời gian theo dõi 3 tháng [32], [38], [39]. Trong số các bệnh nhân nghi ngờ TĐMP cấp, kết quả D-dimer âm tính bằng kỹ thuật ELISA nhanh gặp 31-33% trong số bệnh nhân có khả năng lâm sàng không phù hợp TĐMP theo bảng điểm Wells hoặc khả năng lâm sàng thấp hoặc trung bình theo bảng điểm Geneva [24], [39], [52].
-
Phối hợp D-dimer với NT-proBNP trong loại trừ TĐMP
Những mảnh pro-BNP (pro-B type natriuretic peptide), BNP (B-type natriuretic peptide), và NT-proBNP (aminoterminal B-type natriuretic peptide) được phóng thích vào tuần hoàn do sự căng quá mức cơ tim và tình trạng quá tải thể tích [29], [39]. Tăng peptide bài natri đã được mô tả ở những bệnh nhân TĐMP, đặc biệt ở những bệnh nhân TĐMP có cứng thất phải. Nếu có tình trạng quá tải thất phải xảy ra, cả hai thành phần BNP và NT-proBNP đều được sử dụng để dự báo tiên lượng xấu ở những bệnh nhân TĐMP [1], [7]. Về lý thuyết, có thể suy đoán một giá trị NT-proBNP thấp kết hợp với D-dimer thấp sẽ giúp tăng khả năng loại trừ TĐMP so với giá trị D-dimer thấp đơn thuần [10]. Một nghiên cứu đã đề xuất lợi ích tiềm tàng của việc kết hợp hai giá trị xét nghiệm trong chẩn đoán và tiên lượng TĐMP, tuy nhiên kết quả vẫn chưa được ứng dụng trên lâm sàng [17], [38], [44]. D-dimer, được đo bằng kỹ thuật ngưng kết latex định lượng, và xét nghiệm NT-proBNP được đánh giá ở 19 bệnh nhân biểu hiện khó thở được chẩn đoán có TĐMP so với 199 bệnh nhân khó thở nhưng không nghi ngờ TĐMP [37], [48]. Các bệnh nhân trong nhóm chứng thường có nhiễm trùng phổi, đợt cấp của bệnh phổi tắc nghẽn mạn tính, hoặc hen phế quản. Trong số 199 bệnh nhân không có TĐMP, độ đặc hiệu của giá trị D-dimer thấp đơn thuần là 72% và độ đặc hiệu hoặc D-dimer thấp hoặc NT-proBNP thấp là 85% [19], [52]. Tuy nhiên, trị số dự báo âm là tương tự ở hai nhóm. NPV của D-dimer đơn thuần là 143/144 (99%) và của NT-proBNP là 115/119 (97%). NPV phối hợp D-dimer thấp và NT-proBNP thấp là 169/173 (98%) [11], [30].
III. KẾT LUẬN
D-dimer là dạng FDP lưu hành nhỏ nhất đặc hiệu cho quá trình tiêu fibrin. Các nhà lâm sàng sẽ phát hiện thấy giá trị của xét nghiệm D-dimer thay đổi theo hoàn cảnh lâm sàng, bởi vì có sự thay đổi trong các phương pháp xét nghiệm. Vì vậy cần phải biết các phương pháp xét nghiệm đang thực hiện tại địa phương, khoảng giá trị tham chiếu, cho dù các xét nghiệm có thể được sử dụng để loại trừ TTHKTM, và nếu như vậy phải dựa trên ngưỡng khuyến cáo của phòng xét nghiệm D-dimer để loại trừ TTHKTM. Chúng ta có thể thấy xét nghiệm D-dimer có độ nhạy cao, nhưng có thể thất vọng vì độ đặc hiệu thấp.
Các xét nghiệm D-dimer đã được sử dụng trong gần 30 năm trong chẩn đoán và theo dõi bệnh nhân DIC. Từ đầu những năm 1990, xét nghiệm đã được công nhận để loại trừ TTHKTM tại các trung tâm cấp cứu. Trong số những bệnh nhân TTHKTM đã kết thúc liệu pháp chống đông, D-dimer có thể được sử dụng để đánh giá nguy cơ huyết khối tái phát sau ngừng thuốc. D-dimer tăng theo tuổi cao và sự tiến triển của thai kỳ, chính vì vậy giá trị của D-dimer sẽ hạn chế khi đánh giá khả năng TTHKTM ở những đối tượng này, tương tự như vậy, D-dimer cũng tăng cao ở bệnh nhân có bệnh ác tính, đặc biệt ở giai đoạn muộn.
TÀI LIỆU THAM KHẢO
1. Zamorano J, Achenbach S, Baumgartner H, et al. (2014). “2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism”. Eur Heart J; ESC Guidelines: 1-48.
2. Cushman M. (2007). “Epidemiology and Risk Factors for Venous Thrombosis”. Semin Hematol; 44(2): 62-69.
3. Tapson V. (2008). “Acute Pulmonary Embolism ”. N Engl J Med; 358: 1037-1052.
4. Pipavath S, Godwin J. (2008). “Acute Pulmonary Thromboembolism A Historical Perspective”. AJR; 191: 639-641.
5. Goldhaber S, Elliott C. (2003). “Acute Pulmonary Embolism Part II Risk Stratification, Treatment, and Prevention”. Circulation; 108: 2834-2838.
6. Dokwal C. (2011). “Diagnosis and Management of Acute Pulmonary Embolism”. Pulse Volume; 5(2): 31-40.
7. Kostadima E, Zakynthinos E. (2007). “Pulmonary Embolism Pathophysiology, Diagnosis, Treatment”. Hellenic J Cardiol; 48: 94-107.
8. Campbell I, Fennerty A, Miller A, et al. (2003). “British Thoracic Society guidelines for the management of suspected acute pulmonary embolism”. Thorax; 58: 470-484.
9. Salaun P, Couturaud F, Duc-Pennec A, et al. (2011). “Noninvasive Diagnosis of Pulmonary Embolism”. Chest; 139(6): 1294–1298.
10. Goldhaber S, Elliott C. (2003). “Acute Pulmonary Embolism Part I Epidemiology, Pathophysiology, and Diagnosis”. Circulation; 108: 2726-2729.
11. Bruinstroop E, van de Ree MA, Huisman MV. (2009). “The use of D-dimer in specific clinical conditions: a narrative review”. Eur J Intern Med; 20(5): 441-446.
12. Ahearn G, Bounameaux H. (2000). “The Role of the D-Dimer in the Diagnosis of Venous Thromboembolism”. SEMINARS IN RESPIRATORY AND CRITICAL CARE MEDICINE; 21(6): 521-536.
13. Kearon C, Ginsberg J, Douketis J, et al. (2006). “An Evaluation ofD-Dimer in the Diagnosis of Pulmonary Embolism”. Ann Intern Med; 144: 812-821.
14. Adam SS, Key NS, Greenberg CS. (2009). “D-dimer antigen: current concepts and future prospects”. Blood; 113(13): 2878-2887.
15. Lichey J, Reschofskia I, Dissmann T, et al. (1991). “Fibrin Degradation Product D-Dimer in the Diagnosis of Pulmonary Embolism”. Klin Wochenschr; 69: 522-526.
16. Olson JD. (2015). “D-dimer: An Overview of Hemostasis and Fibrinolysis, Assays, and Clinical Applications”. Adv Clin Chem; 69: 1-46.
17. Kelly J, Rudd A, Lewis R, et al. (2002). “ Plasma D-Dimers in the Diagnosis of Venous Thromboembolism”. Arch Intern Med; 164: 747-756.
18. Gupta RT, Kakarla RK, Kirshenbaum KJ, et al. (2009). “D-dimers and efficacy of clinical risk estimation algorithms: sensitivity in evaluation of acute pulmonary embolism”. AJR Am J Roentgenol; 193(2): 425-430.
19. Lobo JL, Zorrilla V, Aizpuru F, et al. (2009). “D-dimer levels and 15-day outcome in acute pulmonary embolism. Findings from the RIETE Registry”. J Thromb Haemost; 7(11): 1795-1801.
20. Frost SD, Brotman DJ, Michota FA. (2003). “Rational use of D-dimer measurement to exclude acute venous thromboembolic disease”. Mayo Clin Proc; 78(11): 1385-1391.
21. Stein P, Hull R, Patel K, et al. (2004). “D-Dimer for the Exclusion of Acute Venous Thrombosis and Pulmonary Embolism”. Ann Intern Med; 140: 589-602.
22. Bounameaux H, Cirafici P, De Moerloose P, et al. (1991). “Measurement of D-dimer in plasma as diagnostic aid in suspected pulmonary embolism”. Lancet; 337: 196-200.
23. Righini M, Van Es J, Den Exter P. (2014). “In suspected PE, an age-adjusted D-dimer cutpoint improved ability to exclude PE”. JAMA; 311(1117-1124).
24. Verhovsek M, Douketis J, Yi Q, et al. (2008). “Systematic ReviewD-Dimer to Predict Recurrent Disease after Stopping Anticoagulant Therapy for Unprovoked Venous Thromboembolism”. Ann Intern Med; 149: 481-490.
25. Abcarian P, Sweet J, Watabe J, et al. (2004). “Role of a Quantitative D-Dimer Assay in Determining the Need for CT Angiography of Acute Pulmonary Embolism”. AJR; 182: 1377–1381.
26. Rathbun S, Whitsett T, Raskob G. (2004). “NegativeD-Dimer Result To Exclude Recurrent Deep Venous Thrombosis A Management Trial”. Ann Intern Med; 141: 839-845.
27. Akpinar EE, Hosgun D, Doganay B, et al. (2013). “Should the cut-off value of D-dimer be elevated to exclude pulmonary embolism in acute exacerbation of COPD?”. J Thorac Dis; 5(4): 430-434.
28. Dunn K, Jonathan B, Wolf P, et al. (2002). “NormalD-Dimer Levels in Emergency Department Patients Suspected of Acute Pulmonary Embolism”. J Am Coll Cardiol; 40(8): 1475–1478.
29. Agnelli G, Becattini C. (2010). “Acute Pulmonary Embolism”. N Engl J Med; 363: 266-274.
30. Dinisio M, Squizzato A, Rutjes A, et al. (2007). “Diagnostic accuracy of D-dimer test for exclusion of venous thromboembolism a systematic review”. J Thromb Haemost; 5: 296-304.
31. Owaidah T, AlGhasham N, AlGhamdi S, et al. (2014). “Evaluation of the usefulness of a D dimer test in combination with clinical pretest probability score in the prediction and exclusion of Venous Thromboembolism by medical residents”. Thrombosis Journal; 12(28-34).
32. Righini M, Van Es J, Den Exter PL, et al. (2014). “Age-adjusted D-dimer cutoff levels to rule out pulmonary embolism: the ADJUST-PE study”. JAMA; 311(11): 1117-1124.
33. Tripodi A. (2011). “D-dimer testing in laboratory practice”. Clin Chem; 57(9): 1256-1262.
34. Pathak V, Rendon I, Muthyala P. (2011). “Elevated D-dimer is not always pulmonary embolism”. Respiratory Medicine CME; 4(2): 91-92.
35. Ghanima W, Abdelnoor M, Holmen LO, et al. (2007). “D-dimer level is associated with the extent of pulmonary embolism”. Thromb Res; 120(2): 281-288.
36. Janssen M, Wollersheim H, Verbruggen B, et al. (1998). “Rapid D-Dimer Assays to Exclude Deep Venous Thrombosis and Pulmonary Embolism Current Status and New Developments”. Seminars in Thrombosis and Hemostasis; 24(4): 393-400.
37. Prisco D, Grifoni E. (2009). “The role of D-dimer testing in patients with suspected venous thromboembolism”. Semin Thromb Hemost; 35(1): 50-59.
38. Quinn D, Fogel R, Smith C, et al. (1999). “D-Dimers in the Diagnosis of Pulmonary Embolism”. Am J Respir Crit Care Med; 159: 1445-1449.
39. Weber J. (2014). “Venous Thromboembolic Disease”. J Am Osteopath Coll Radiol; 3(3): 1-7.
40. Youssf ARI, Ismail MFM, ElGhamry R, et al. (2014). “Diagnostic accuracy of D-dimer assay in suspected pulmonary embolism patients”. Egyptian Journal of Chest Diseases and Tuberculosis; 63(2): 411-417.
41. Pulivarthi S, Gurram MK. (2014). “Effectiveness of d-dimer as a screening test for venous thromboembolism: an update”. N Am J Med Sci; 6(10): 491-499.
42. Bates S, Kearon C, Crowther M, et al. (2003). “A Diagnostic Strategy Involving a Quantitative LatexD-Dimer Assay Reliably Excludes Deep Venous Thrombosis”. Ann Intern Med; 138: 787-794.
43. Gomez V, Miguel-Diez J, Portillo A, et al. (2014). “D-Dimer Specificity for the Diagnosis of Acute Symptomatic Pulmonary Embolism”. J Hematol Thrombo Dis; 2(6): 1-5.
44. Nazerian P, Vanni S, Volpicelli G. (2014). “In suspected PE with Wells score 4 or positive D-dimer, multiorgan ultrasonography had 90% sensitivity for PE”. Chest; 145: 950-957.
45. Woller SC, Stevens SM, Adams DM, et al. (2014). “Assessment of the safety and efficiency of using an age-adjusted D-dimer threshold to exclude suspected pulmonary embolism”. Chest; 146(6): 1444-1451.
46. Piazza G, Goldhaber SZ. (2006). “Acute pulmonary embolism: part I: epidemiology and diagnosis”. Circulation; 114(2): e28-32.
47. Kearon C, Spencer FA, O'Keeffe D, et al. (2015). “D-dimer testing to select patients with a first unprovoked venous thromboembolism who can stop anticoagulant therapy: a cohort study”. Ann Intern Med; 162(1): 27-34.
48. Kearon C, Ginsberg J, Douketis J, et al. (2001). “Management of Suspected Deep Venous Thrombosis in Outpatients by Using Clinical Assessment andD-Dimer Testing”. Ann Intern Med; 135: 108-111.
49. Ullman E, Brady W, Perron A, et al. (2001). “Electrocardiographic manifestations pulmonary embolism”. Am J Emerg Med; 19: 514-519.
50. King V, Vaze A, Moskowitz C, et al. (2008). “D-Dimer Assay to Exclude Pulmonary Embolism in HighRisk Oncologic Population: Correlation with CT Pulmonary Angiography in an Urgent Care SettingPopulation”. Radiology; 247: 854–861.
51. Coskun F, Yilmaz D, Ursavas A, et al. (2010). “Relationship between disease severity and D-dimer levels measured with two different methods in pulmonary embolism patients”. Multidisciplinary Respiratory Medicine; 5(3): 168-172.
52. Tick LW, Nijkeuter M, Kramer MH, et al. (2008). “High D-dimer levels increase the likelihood of pulmonary embolism”. J Intern Med; 264(2): 195-200.
ThS.BS. Nguyễn Quang Đợi
Trưởng khoa Hô Hấp – Bệnh viện đa khoa tỉnh Hải Dương